Tema: introducción a la biofísica fenómenos biofísicos moleculares
EL PRINCIPIO DE LA BIOFÍSICA
En definitiva es un puente que conecta las disciplinas clásicas, las cuales son: la biología y la física.
Biología
Estudia todo lo relacionado a las diferentes variedades de vida existentes en la tierra y su extrema complejidad, describiéndolo así todos sus hábitos de alimentación, comunicación, relación con el medio que los rodea y su reproducción. (UNSE, 2013)
Física
Esta ciencia se concentra en todo lo que tenga que ver con las leyes matemáticas en el gran y complejo mundo de la naturaleza, realiza predicciones precisas de lo que las fuerzas podrían llegar a conducir los procesos en sistemas ideales, su explicación científica es muy predecible. (UNSE, 2013)
 |
| Fuente: https://www.lavanguardia.com/r/GODO/LV/p5/WebSite/2018/04/23/Recortada/img_jfita_20171106-174803_imagenes_lv_getty_istock-610144848-kPaB-U442882206057RUG-992x558@LaVanguardia-Web.jpg |
La formación del
universo y el origen de la vida
La formación del
universo y el origen de la vida
Teoría o hipótesis del Big Bang (Gran explosión)
Esta teoría da a conocer que la creación de universo se remonta a unos 14.000 millones de años con una gran explosión. Después de lo ocurrido, se creó el espacio, el tiempo, la energía y la materia. Todo lo que conocemos como la ropa, el agua, los árboles, nuestros coches y casas, absolutamente todo esto está ligado por la materia formada por la aquella gran explosión. (Hubble, 2014)
 |
| Fuente: https://cdn.hispantv.com/hispanmedia/files/images/thumbnail/20171129/02341618_xl.jpg |
La Teoría de la Panspermia: El Origen Extraterrestre de la Vida
Esta teoría fue propuesta por Svanthe Arrhenius, físico y químico sueco (1859-1927), a principios del siglo XX. La teoría trata de explicar que la vida se desarrolló a partir de microorganismos, que en forma de esporas, llegaron del espacio exterior, por lo que afirmaba lo siguiente:
- · “Que las corrientes de aire producidas por las erupciones volcánicas son capaces de elevar partículas pequeñas a más de 100Km sobre la superficie terrestres”.
- · “Que las descargas eléctricas que se producían en las capas superiores de la atmosfera arrojaban las partículas fuera de los límites del planeta”.
- · “Las partículas en el espacio se desplazaban por la presión de los rayos solares hasta otros astros”. (Vargas, 2014)
Sin embargo, hubo científicos que no estuvieron de acuerdo con ese análisis, porque:
- · Las esporas se sometían al sobre calentamiento por fricción en la atmosfera.
- · Porque se exponen en el frío, la falta de oxígeno y humedad en el espacio interestelar.
- · Porque los rayos ultravioletas destruyen cualquier tipo de microorganismos. (Vargas, 2014)
 |
| Fuente: https://static.vix.com/es/sites/default/files/btg/curiosidades.batanga.com/files/Datos-interesantes-sobre-los-asteroides-5.jpg |
Oparin y el Origen de la Vida
Un joven bioquímico llamado Alexander Ivanovich Oparin (1894-1980) publicó un libro en 1924, titulado El Origen de la Vida, que posteriormente perfeccionó y actualizó en su segundo libro bajo el mismo título, publicado en 1936, el cual propone que la vida surgió de una larga evolución química que había precedido a la evolución biológica. Oparin planteo que recién formado el planeta Tierra, la atmósfera primitiva era muy diferente a la actual, el cual pensaba que esta era reductora rica en hidrógeno (H2), metano (CH4) y amoniaco (NH3), pero principalmente carente de oxígeno libre (O2),y que estos sencillos compuestos fueron sometidos a diversas fuentes energéticas, como la energía originada por descargas eléctricas que se presentaban por aquellos tiempos, la energía térmica emanada de las erupciones volcánicas y la energía de onda corta, que procedía del sol como los rayos X, (gama) y ultravioleta (UV). Y de ahí se crearon los componentes de la atmosfera, los cuales se precipitaron a los mares primitivos para formar lo que se denominarían la sopa primigenia. A partir de ahí se formaron proteínas, lípidos, carbohidratos y ácidos nucleicos que posteriormente, se ensamblaron para formar sistemas pre-celulares microscópicos como los coacervados y a partir de estos evolucionaron los primeros seres vivos.
El Origen Quimiosintético de la Vida.
El origen y evolución del universo.
Se dice q hace ya aproximadamente 12 millones de años toda la energía y la materia se centraba en una sola región. A partir de ese punto se empezó a expandir y enfriarse con tal rapidez, que llego a formar partículas elementales de energía llamadas quarks. Todo esto ocurrió en los primeros minutos de la expansión, transcurridos 300,000 años el cosmos alcanzo un tamaño mil veces menor que el actual, en estos momentos se formaron los átomos neutros (átomos en los que no existe diferencia de cargas eléctricas), las cuáles se concentraron en densas nubes de gas que se transformarían en estrellas. Cuando el universo se expandió hasta una quinta parte de su tamaño actual, las estrellas se agruparon para formar las primeras galaxias.
Los elementos más pesados, como el plomo o el uranio se sintetizaron gracias a las ondas de choque generadas por la explosión de las supernovas, es necesario un gran aporte de energía para que se lleve a cabo la formación de núcleos pesados. A partir de estos elementos se formaron los planetas, hasta este momento el cosmos alcanzo su talla actual. Esta teoría que explica el origen y evolución del universo se conoce como cosmología de la gran explosión o Big Bang. (Lugo, 2014)
El Origen de la Vida.
Se remonta aproximadamente 4 millones de años, una vez que se crearon las condiciones en la Tierra primitiva, la vida pudo surgir abióticamente, gracias a la interacción de las diversas fuerzas energéticas en combinación con sencillas moléculas presentes en la atmósfera primitiva. Por esos tiempos, la Tierra primitiva tenía una gran actividad volcánica, el cual, emanaba muchos materiales sólidos, líquidos y gaseosos. Una vez que empezó a bajar la temperatura, el vapor de agua comenzó a condensarse y a precipitarse en las cuencas de la superficie terrestre para formar los océanos. La Tierra era un blanco perfecto por la cual se impactaban muchos meteoritos y cuerpos celestes que generaban una gran cantidad de energía térmica. El cual permitió que una serie de transformaciones pudieran dar paso al origen de lo que hoy conocemos como vida.
 |
La biofísica y la medicina moderna
El conocimiento en
biofísica nos ha ayudado a entender los fenómenos fisiológicos de nuestro
organismo en estado normal y patológico. Por ejemplo, la transmisión del
impulso nervioso. (Chalén, 2015)
¿Qué es el método científico?
Es una actividad cuyo objetivo es la obtención de conocimientos científicos, para facilitar su trabajo e incrementar sus posibilidades de éxito, necesitan diseñar y planear su forma de proceder en la investigación; es decir, deben seguir un método que, aunque no produzca automáticamente conocimiento ni sea infalible, sí permita eliminar las improvisaciones, y por ende, evite la obtención de resultados confusos.
En el método científico se distinguen dos aspectos:
1. Es un proceso que impone orden en la investigación científica.
2. Planea las actividades, los procedimientos, recursos y conocimientos necesarios para una investigación.
Etapas del método científico
En términos generales, las etapas de cualquier investigación científica son:
1. Plantear un problema que se necesita resolver. Entendemos por problema cualquier dificultad que no tiene solución automática.
2. Suponer una solución a partir de la formulación de una hipótesis.
3. Comprobar la hipótesis, es decir, aportar evidencias de su veracidad.
4. Si se comprueba la hipótesis se debe interpretar el resultado obtenido en los términos de la teoría correspondiente.
5. La inserción del resultado en el sistema de los conocimientos adquiridos, es decir, su incorporación al cuerpo de conocimientos de la ciencia.
6. Indagar posibles consecuencias del resultado.
6. El surgimiento de nuevos problemas.
Procedimientos específicos del método científico.
Los procedimientos para comprobar las hipótesis son:
• La demostración formal.
• La verificación.
(Carvajal I. J., 2013)
(Carvajal I. J., 2013)
Métodos que se utilizan en la investigación científica
En el proceso de la investigación científica se utilizan procedimientos tanto empíricos (significa experiencia) como racionales. El aspecto empírico se refiere al uso de los sentidos, tanto en la observación de los fenómenos como en la experimentación. El uso de los sentidos, la observación, el manejo de datos y hechos o fenómenos que se están investigando son aplicaciones empíricas. La observación es un procedimiento empírico que consiste en fijar la atención de un hecho o fenómeno para percibirlo por medio de los sentidos y así obtener información acerca de su comportamiento. (Carvajal I. J., 2013)
Los siguientes métodos racionales son parte del método científico:
• La inducción
• La deducción
• La inferencia por analogía
La Estructura de la Materia
El núcleo atómico
En el átomo, los protones y neutrones forman un núcleo atómico central extremadamente pequeño (de radio aproximado 10-15 m, unas 100 000 veces más pequeño que el radio del átomo) y muy pesado (más del 99% de la masa del átomo).
En el núcleo se concentra prácticamente toda la masa atómica, pero, en cambio, el volumen del núcleo es una parte muy pequeña del volumen atómico. En el átomo tenemos tres partículas fundamentales: electrón, protón y neutrón y, desde el punto de vista eléctrico, el núcleo que es positivo y la corteza negativa. Ambas cargas en total son iguales, por lo que el átomo es neutro. Y desde el punto de vista másico en el núcleo reside prácticamente la totalidad de la masa del átomo.
El número atómico
Un átomo se distingue del de otro elemento en el número de partículas subatómicas elementales. En este sentido, se comprobó que en diferentes elementos al pasar de uno al otro el número de protones (y, por tanto, el de electrones) aumentaba de una en una unidad.
Las propiedades químicas de los elementos dependen solamente del número de electrones de sus átomos (de su distribución exterior, que estudiaremos a continuación), que, como acabamos de ver, en los átomos neutros es igual al número de protones contenidos en el núcleo, esto es, igual al número atómico que, por tanto, es la característica única de cada elemento. (Vazquez, 2013)
El numero Másico
Se representa por la letra A, que se sitúa como superíndice a la izquierda del símbolo del elemento. Por tanto, el núcleo de los átomos de un elemento químico está compuesto por un número fijo de protones y un número variable de neutrones, partículas que denominamos conjuntamente nucleones. Con excepción de la forma más común del hidrogeno, 1H, que tiene 1 protón y no tiene neutrones, todos los demás núcleos atómicos contienen protones y neutrones. (Vazquez, 2013)
· Número másico, A, es el número de protones y neutrones presentes en el núcleo de un átomo de un elemento.
Los Elementos
Los elementos son sustancias que no se pueden dividir en sustancias más simples por medio de reacciones químicas ordinarias. Cada elemento tiene un símbolo químico: en general la primera letra o las primera y segunda letras del nombre del elemento en inglés o en latín.
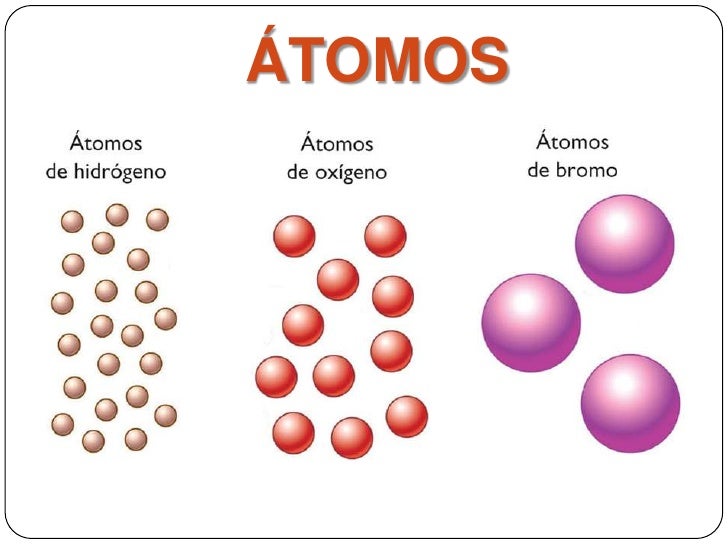
Los átomos
En la actualidad se considera al átomo como la parte material más pequeña de un elemento que contiene en su interior partículas subatómicas denominadas electrones, protones y neutrones. Adicionalmente, existen más partículas subatómicas como los quarks y los gluones, pero nos dedicaremos a las partículas más conocidas. Un átomo es eléctricamente neutro lo que significa que el número de cargas negativas y positivas son iguales. Existen diferentes tipos de átomos con igual número de masa y se llaman isóbaros, como también diferentes tipos de átomos que tienen igual número de neutrones y se denominan isótonos y los isótopos que son átomos de un mismo elemento con diferente número de neutrones y por lo tanto diferente número de masa. (Gonzalez, 2012)
 |
| Fuente: https://image.slidesharecdn.com/tomosmolculasycristales-120430090748-phpapp01/95/tomos-molculas-y-cristales-2-728.jpg?cb=1335776932 |
Las moléculas
Las partículas formadas por dos o más átomos se conocen como moléculas que se mantienen juntas por medio de enlaces químicos. Dos tipos comunes son los enlaces iónicos y los enlaces covalentes. (Gonzalez, 2012)
 |
| Fuente: https://informaticaaplicadagmp.files.wordpress.com/2016/05/mol2.png?w=768 |
La teoría cuántica del átomo
La teoría cuántica
Se originó en 1900 y la mecánica cuántica 25 años después. Dicha teoría constituye un cambio de paradigma en la ciencia del siglo XIX que dio paso a una nueva visión del mundo en el siglo XX. Es una disciplina de la física que aplica los principios de la mecánica cuántica a los sistemas clásicos de campos continuos, por ejemplo, el campo electromagnético.
El modelo estándar
El modelo estándar de física de partículas
El modelo estándar es una teoría cuántica de campos desarrollada entre 1970 y 1973 que es consistente con la mecánica cuántica y la relatividad especial. Este modelo de física de partículas viene a representar lo que son los “átomos actuales”. El modelo estándar pretende integrar las cuatro interacciones fundamentales existentes, pero solo ha podido hacerlo con tres, quedando fuera de dicho modelo la interacción gravitacional, por lo cual aún se le considera incompleta. Hasta la fecha, casi todas las pruebas experimentales de las tres fuerzas descritas por el modelo estándar están de acuerdo con sus predicciones. Dichas fuerzas son la electromagnética, la nuclear débil y el nuclear fuerte.
El modelo estándar agrupa dos teorías importantes
El modelo electro débil y el cromo dinámico cuántico, lo cual proporciona una teoría internamente consistente que describe las interacciones entre todas las partículas observadas experimentalmente. Técnicamente, la teoría cuántica de campos proporciona el marco matemático para el modelo estándar, el cual describe cada tipo de partícula en términos de un campo matemático. (Chumacero, 2014)
El modelo estándar se puede dividir en tres partes
Partículas de materia, partículas mediadoras de las fuerzas y el bosón de Higgs.
- Partículas de materia Toda la materia conocida está constituida de partículas que tienen una propiedad intrínseca llamada espín. En los términos del modelo estándar todas las partículas son fermiones, por esta razón siguen el principio de exclusión de Pauli, de acuerdo con la estadística del espín, y es lo que causa su calidad de materia.
- Partículas mediadoras de fuerza Las fuerzas son la forma en la que las partículas interactúan recíprocamente y se incluyen mutuamente. El modelo estándar explica tales fuerzas como el resultado del intercambio de otras partículas conocidas como las partículas mediadoras de fuerza.
- Bosón de Higgs La partícula de Higgs es una partícula elemental escalar masiva predicha por el modelo estándar, y que al parecer acaba de ser descubierta en el CERN Europeo en 2012. Tiene espín 0 por lo que es un bosón. Dicha partícula explica los orígenes de la masa de otras partículas elementales, particularmente la diferencia entre el fotón sin masa y los bosones pesados W y Z. (Chumacero, 2014)
El neutrón
En 1920, el científico E. Rutherford se observó que la suma de las masas de los electrones y protones, que forman un átomo, era muy inferior a la masa total del átomo llamada masa atómica. Así, comprobó que la mayoría de los átomos exhibían, aproximadamente, una masa atómica doble a la esperada. Por tanto, hasta confirmarlo experimentalmente, Rutherford postuló la existencia de otra partícula subatómica, denominada neutrón, que carecía de carga eléctrica, poseía una masa, aproximadamente, igual a la del protón y estaba situada en el núcleo.
El protón
La existencia de una partícula subatómica de carga negativa llevó a los científicos a plantear la búsqueda de una partícula subatómica de carga positiva, necesaria porque conocían que la materia era neutra. Por este motivo se consideró la existencia de otra partícula fundamental del átomo a la que se denominó protón, cuya carga, en valor absoluto, era igual a la del electrón, aunque sus masas fuesen diferentes. (Pico, 2013)
El electrón
El electrón fue la primera partícula subatómica descubierta y durante algún tiempo fue la única conocida. En 1897, el físico inglés J. J. Thomson, al estudiar el comportamiento y los efectos de los rayos catódicos comprobó que estaban constituidos por partículas negativas cuya naturaleza era independiente del gas que se encerrara en el tubo. Este hecho le llevó a pensar que estas partículas debían ser constituyentes fundamentales de toda la materia y las llamo electrones, suponiéndolas como partículas elementales (o átomos) de la electricidad o como cargas eléctricas elementales. (Pico, 2013)
El positrón
También llamado electrón positivo , partícula subatómica con carga positiva que tiene la misma masa y magnitud de carga que el electrón y que constituye la antipartícula de un electrón negativo . Los positrones se emiten en la desintegración beta positiva de núcleos radiactivos ricos en protones (deficientes en neutrones) y se forman en la producción de pares , en los que la energía de un rayo gamma en el campo de un núcleo se convierte en un par electrón-positrón. (Pico, 2013)
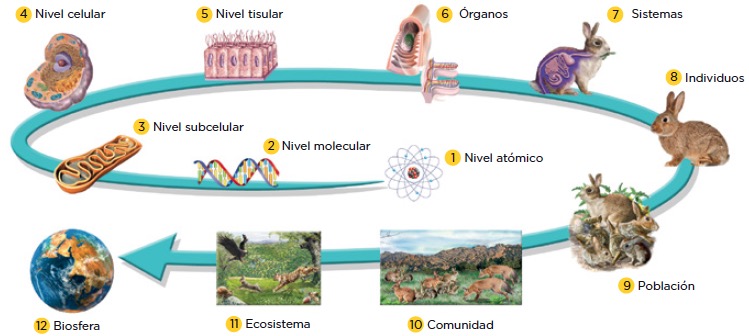
Niveles de Organización de los Seres Vivos
Niveles de Organización de los Seres Vivos
· Subatómico: Los átomos no son indivisibles, tienen una estructura interna que están formados por partículas aún más pequeñas, llamadas por ello partículas subatómicas que son: electrones, protones y neutrones.
· Átomo: Es considerado la menor porción de materia existente, la cual una unidad básica de un elemento que puede intervenir en una combinación química.
· Molécula: Los átomos se combinan químicamente para formar moléculas. Dos átomos de hidrógeno se combinan con un átomo de oxígeno para formar una sola molécula de agua.
· Célula: A nivel celular, muchos tipos de átomos y moléculas se asocian entre sí para formar células. (Solomon E. , 2013)
· Tejido: las células se asociaron para formar tejidos tejido muscular.
· Órgano: Los tejidos se organizan en estructuras funcionales llamadas órganos, tales como el corazón y el estómago. (Solomon E. , 2013)
• Sistema: Grupo principal de funciones biológicas lo realiza un grupo coordinado de tejidos y órganos llamado sistema de órgano. (Solomon E. , 2013)
• Organismo: El conjunto con gran precisión, los sistemas de órganos constituyen un complejo organismo multicelular. (Lugo, 2014)
· Población: Una población, “consiste en un grupo de organismos de la misma especie que viven en un lugar y tiempo determinado, y que interaccionan tanto genética como ecológicamente”. Tienen propiedades que los distinguen como son: por ejemplo, que comparten un acervo genético, pueden presentar cambios en las frecuencias génicas como resultado de la selección natural, lo cual propicia cambios adaptativos en la población.
· Comunidad: Se llama comunidad, al conjunto de poblaciones de diferentes especies que viven e interactúan en un tiempo y espacio determinado. Estas presentan límites tanto espaciales como temporales.
· Ecosistema: Es una unidad formada por los seres vivos y el ambiente no vivo, en la que existen interacciones vitales, fluye la energía y circula la materia, como ejemplos de ecosistemas, tenemos a la selva, el bosque, un lago, etc.
· Biosfera: La biosfera está constituida por todos los ecosistemas que existen en la Tierra, incluyendo todas las interacciones que se dan entre las comunidades y el ambiente abiótico (agua, suelo, rocas, atmósfera, etc.), los organismos que viven en ella, dependen unos de otros y del ambiente físico de la Tierra para sobrevivir.
· Bioma: Los biomas se definen como grandes extensiones de la Tierra, que se caracterizan por presentar clima, suelo, vegetación y fauna similares. La temperatura y la precipitación, son los factores abióticos más importantes en un bioma, ya que estos determinan el tipo de organismos característicos de cada región. (Lugo, 2014)
 |
| Fuente: https://www.blinklearning.com/useruploads/ctx/a/41514490/r/s/9991980/Capturadepantalla2016-05-23alas12.59.55.jpg |
Nivel
subatómico. Comprende las
partículas subatómicas (protones y electrones).
Nivel atómico. Comprende los átomos (carbono, hidrógeno,
oxígeno, etc.)
Nivel
molecular. Comprende las
moléculas que son la unión de dos o más átomos. (agua =H2O, glucosa=C6H12O 6,
etc.)
Nivel celular. Comprende las células
(nerviosas, musculares, etc.)
Nivel
pluricelular.
Comprende los tejidos, los órganos , los sistemas y los aparatos (tejido
conjuntivo, el riñón, el sistema nervioso, el aparato respiratorio, etc.)
Clasificación de los compuestos químicos
| Fuente: http://iespoetaclaudio.centros.educa.jcyl.es/sitio/upload/img/org_materia_viva.gif |
Compuestos binarios: Los compuestos binarios resultan de la combinación de dos elementos, por esta razón en sus fórmulas intervienen sólo dos símbolos. La combinación de los compuestos binarios puede ser entre un metal y un no metal y entre dos no metales.
Compuestos terciarios: Están conformados por la combinación de tres elementos diferentes que se los conoce como: oxácidos, oxisales e hidróxidos. Para formular es conveniente aplicar la misma regla utilizada con los compuestos binarios; pero para ello, se puede considerar el anión poliatómico como un grupo fijo con carga negativa, el metal o el hidrógeno con carga positiva y luego proceder de igual manera.
Hidróxidos: Un hidróxido está formado por la combinación del grupo hidroxilo OH- con un metal o con el grupo amonio NH4 +. El grupo OH- es un caso típico de ion poliatómico negativo; con respecto a la nomenclatura se trata como si fuera un solo elemento con grado de oxidación -1. Los hidróxidos se comportan químicamente como bases.
Oxácidos: Son ácidos formados por la combinación de hidrógeno H, oxígeno O y otro elemento, metálico o no metálico. Su fórmula típica es HaXbOc. En ellos el oxígeno actúa con número de oxidación -2 y el hidrógeno con +1. Cuando se conoce la fórmula y se considera que la carga total de la molécula es cero, resulta fácil determinar el número de oxidación correspondiente al elemento central, que como sabemos es positivo. Ej.: ácido clórico HClO3, ácido crómico H2CrO4.
Oxídales: Son compuestos formados por un metal y un ion poliatómico, cuyo elemento central, al igual que los ácidos puede ser un metal o un no metal. La carga total de la molécula es cero y el número de oxidación del elemento central es positivo. Ej.: carbonato de sodio Na2CO3, permanganato de potasio KMnO4.
Hidratos: Los hidratos son compuestos químicos, que llevan unidas cierto número de moléculas de agua por unidad de fórmula y que forman parte de la estructura sólida del compuesto. Para nombrar los hidratos se agrega al nombre del compuesto el prefijo mono, di, tri, tetra, penta, hexa, hepta, etc., de acuerdo al número de moléculas de agua que lo acompañan. Ej.: CuSO4. 5 H2O: sulfato de cobre pentahidratado; MgSO4. 7 H2O: sulfato de magnesio heptahidratado.
Óxidos: Los Óxidos son compuestos ternarios, formados por la combinación de tres elementos distintos, Hidrógeno, Oxígeno y otro elemento (E), que en la mayoría de los casos es no metálico. La fórmula general de los oxácidos es: HaEbOc .
Peróxidos: En estos compuestos el oxígeno actúa con número de oxidación -1 y al ser diatómico la fórmula de su anión es O22-(anión peróxido).
Base: Las bases o hidróxidos se caracterizan por tener en solución acuosa el radical hidroxilo. Por lo tanto, los Hidróxidos se forman con en metal y un (OH)-1.
Ácido: Los ácidos son compuesto que se forman con un Hidrogeno y un no metal.
Sal: Las sales se obtienen cuando reacciona un ácido con un hidróxido y se obtiene la sal con liberación de agua. Este tipo de reacción se denomina reacción de neutralización. (Bracciaforte, 2014)
Tabla Periódica
Los elementos clasifican, organiza y distribuye los distintos elementos químicos, conforme a sus propiedades y características; su función principal es establecer un orden específico agrupando elementos. (Sanchez D. M., 2017)
Los grupos de la tabla periódica son:
Estructura electrónica y tabla periódica
Estructura electrónica y tabla periódica
Los elementos están ordenados de acuerdo con su número atómico. Cada fila de la tabla periódica se llama período. El número de cada período corresponde al nivel energético más externo que tiene electrones en ese período de elementos. Los elementos que se comportan en forma similar se encuentran en grupos o familias y forman las columnas de la tabla periódica. Los elementos de un mismo grupo tienen la misma cantidad de electrones de valencia, por eso tienen propiedades químicas similares.
Períodos:
Un período en la tabla periódica (filas) presenta una variación en cuanto a propiedades físicas y químicas similar a la de los otros períodos. Por ejemplo, el primer y segundo período empieza con metales brillantes y reactivos a la izquierda, seguidos por sólidos opacos y no metales reactivos. Cada período termina en un gas noble incoloro y no reactivo. Los electrones de valencia de los elementos de un mismo período van aumentando de izquierda a derecha, esto explica la variación periódica de las propiedades químicas.
Grupos y familias de elementos
Las columnas verticales de elementos de la tabla periódica se llaman grupos cuando se nombran con el número y la letra o familias cuando se los llama por el nombre de la misma (metales alcalinos). Todos los elementos de un mismo grupo tienen la misma cantidad de electrones de valencia.
· Bloque S Todos los elementos del grupo IA tienen un electrón de valencia: un electrón s. Todos los elementos del grupo IIA tienen dos electrones de valencia: dos electrones s.
· Bloque P Todos los elementos de los grupos IIIA, IVA, VA, VIA, VIIA y VIIIA tienen de 1 a 6 electrones respectivamente en el subnivel p más externo.
· Bloque D Los elementos del bloque de los metales de transición, tienen de uno a 10 electrones en el subnivel d más externo.
· Bloque F Los elementos del bloque de los metales de transición interna no se los utiliza habitualmente lo forman la serie de los lantánidos y actínidos.
Estados de la Materia
Debido a las condiciones de presión y temperatura de nuestro entorno estamos acostumbrados a ver el aire como un gas, a los metales como sólidos, al mercurio como un líquido y al agua como liquida, gaseosa o hasta solida; sin embargo, si se alteran esas condiciones, esas sustancias cambian de un estado de agregación a otro. (Chumacero L. A., 2014)
Líquidos
Plasma
Presión Hidrostática
Adhesión
Cohesión
Difusión
Osmosis
Diálisis
Fenómenos Químicos
¿A que denominamos magnitud?
¿Qué es la medición?
Método o formas de medir
¿Qué son las fuerzas intermoleculares?
¿Qué es la energía?
Definición de energía
Solidos
Las partículas que forman un cuerpo macroscópico solido están unidas entre sí por fuerzas muy intensas, de manera que resulta muy difícil separarlas, por esta razón los sólidos tienen una forma bien definida; por otro lado, los sólidos son difíciles de comprimir y no cambian de volumen. Las propiedades de los sólidos se deben precisamente a la forma y a la fuerza con que están unidas sus partículas; algunas de estas propiedades son:
Ejemplo: cráneo, clavia, esternón, etc.
· Dureza o dificultad para rayar el cuerpo; por ejemplo, el diamante es mucho más duro que un trozo de yeso.
· Fragilidad o tendencia a romperse sin deformarse; por ejemplo, el vidrio o el barro cocido son frágiles.
· Ductilidad o facilidad para extenderse y formar hilos; por ejemplo, el cobre del que están hechos los hilos en el interior de los cables de la corriente eléctrica.
· Maleabilidad o capacidad para extenderse en forma de láminas; por ejemplo, el oro y el aluminio son metales muy maleables.
· Elasticidad o tendencia a recuperar su forma original tras ser sometido a una fuerza; por ejemplo, una cinta de goma o un muelle son muy elásticos.
· Flexibilidad o facilidad de doblarse sin romperse; por ejemplo, podemos doblar una varita de mimbre o una hoja de papel sin que se rompan.
· Resistencia o capacidad para soportar pesos sin romperse; por ejemplo, las casas se hacen con vigas de hierro o de hormigón y, junto con los muros, soportan el peso de éstos y del techo.
(Chumacero L. A., 2014)
 |
| Fuente: https://todosalud.com.co/381-large_default/cr%C3%A1neo-humano-tama%C3%B1o-natural.jpg |
Líquidos
Los líquidos no tienen forma propia, sino que adoptan la del recipiente que los contiene excepto en su superficie, aunque en ausencia de fuerzas externas sobre ellos tienden a tomar una forma esférica debido a la atracción entre sus partículas (fuerzas de cohesión). Estas fuerzas también están involucradas en otras propiedades de los líquidos, como la adhesión, la capilaridad y la tensión superficial. (Chumacero L. A., 2014)
· Jugos gástricos
· Sudor
· Saliva
Gases
Las partículas presentes en el estado gaseoso de una sustancia, interactúan con fuerzas muy débiles. Debido a ello, los gases carecen de forma y volumen propios, adoptan la forma y tienden a ocupar todo el volumen del recipiente que los contiene. Los gases pueden comprimirse y expandirse (los líquidos y sólidos lo hacen con mayor dificultad). Al comprimir y enfriar un gas simultáneamente, este puede pasar al estado líquido, como sucede con el gas licuado y ese proceso se conoce como licuefacción. (Chumacero L. A., 2014)
Ejemplo:
· Oxigeno
· Dióxido de Carbono
| Fuente: http://blog.elinsignia.com/wp-content/uploads/2017/11/tumblr_static_tumblr_static_dz4v4iiy70g00scko00kw4os8_640.jpg |
Plasma
Existe un cuarto estado de la materia llamado plasma, que se forman bajo temperaturas y presiones extremadamente altas, haciendo que los impactos entre los electrones sean muy violentos, separándose del núcleo y dejando sólo átomos dispersos. (Portal educativo, 2014)
| Fuente: http://www.doslourdes.net/monogr%C3%A1ficos-globulosrojos-los-anticuerpos.jpg |
Fenómenos biofísicos
Tensión Superficial
Cuando las moléculas de un líquido se atraen entre sí, decimos que el líquido está “cohesionado”. Cuando hay una interface, las moléculas que se encuentran justo debajo de la superficie sienten fuerzas hacia los lados, horizontalmente y hacia abajo.
Presión Hidrostática
La presión hidrostática en un punto del interior de un líquido es directamente proporcional a la densidad del fluido, d, a la profundidad, h, y a la gravedad del lugar. Los fluidos (líquidos y gases) ejercen también una presión, P = d·g·h, sobre cualquier cuerpo sumergido en ellos. La presión será tanto mayor cuanto más denso sea el fluido y mayor la profundidad. (Gato, 2013)
Adhesión
La adhesión o adherencia se concibe como la fuerza de atracción entre las moléculas de distintas sustancias que entran en contacto directo. En el caso de los líquidos, las fuerzas de adherencia se llaman de dispersión (en el caso de sustancias no polares, se les llama fuerzas de dispersión de London).
Cohesión
En general decimos que la cohesión es una fuerza de naturaleza atractiva entre moléculas de una sustancia. Como se vio en la sección de enlaces químicos, las fuerzas intermoleculares están presentes en la formación de moléculas estables, mediante la compartición de electrones. Cabe señalar que las fuerzas intermoleculares o de atracción intermolecular o de enlace son mucho más débiles que las interatómicas. Es responsable de las propiedades como:
1. Elevado punto de ebullición del agua (100 ºC) a 1 atm de presión.
2. La alta solubilidad en agua de muchos compuestos, como el amoniaco, por el alta constante dieléctrica.
3. Que la densidad del hielo sea menor que la del agua líquida, así como su comportamiento anómalo.
4. Son parcialmente responsables de la estructura secundaria, terciaria y cuaternaria de las proteínas y los ácidos nucleicos.
5. Las elevadas fuerzas de cohesión, lo que provoca la formación de una estructura compacta que la convierte en un líquido casi incompresible.
6. Una alta capacidad térmica específica, pues se requiere más energía térmica para romper estos enlaces y cambiar la temperatura de la sustancia.
7. Una mayor tensión superficial en comparación con otros líquidos.
(Chumacero A. R., 2014)
(Chumacero A. R., 2014)
La capilaridad es la capacidad de los líquidos para subir o bajar por un tubo capilar y depende de su tensión superficial y a su vez de la cohesión o fuerza intermolecular del líquido.
El ángulo de contacto o ángulo de mojado es un indicador de qué tanto la superficie del líquido entra en contacto directo con las paredes del tubo, lo que favorece los efectos de las fuerzas de adhesión.
| Fuente: http://www.saberia.com/wp-content/uploads/2011/02/ciencia_venas.jpg |
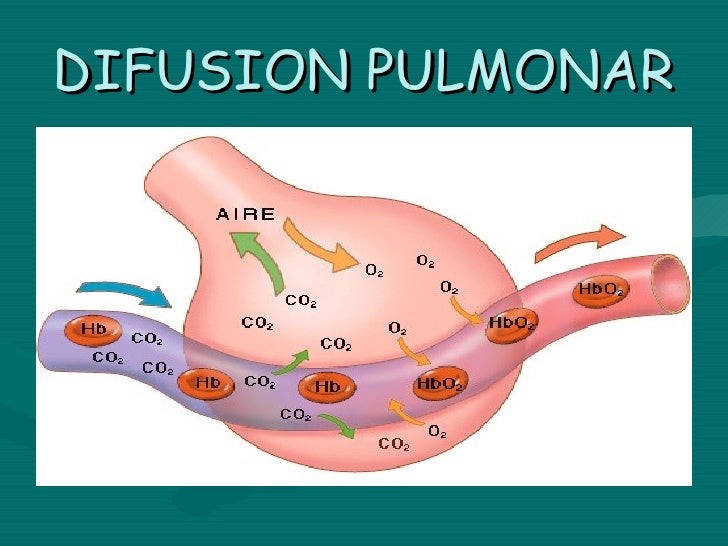
Difusión
La difusión es el movimiento aleatorio de las partículas da como resultado un movimiento neto “a favor” de su propio gradiente de concentración, desde la región de mayor concentración a una de menor concentración.
Fuente: https://image.slidesharecdn.com/fdifusionclasedefinitiva-090930121632-phpapp01/95/difusion-5-728.jpg?cb=1254314111
Difusión simple
La difusión simple es un proceso pasivo que consiste en el movimiento libre de las sustancias a través de la bicapa lipídica sin la ayuda de proteínas transportadoras de membrana. Las moléculas hidrófobas no polares atraviesan la bicapa lipídica a través de este proceso.
La difusión es el movimiento aleatorio de las partículas da como resultado un movimiento neto “a favor” de su propio gradiente de concentración, desde la región de mayor concentración a una de menor concentración.
Difusión simple
 |
| Fuente: https://image.slidesharecdn.com/fdifusionclasedefinitiva-090930121632-phpapp01/95/difusion-5-728.jpg?cb=1254314111 |
La difusión simple es un proceso pasivo que consiste en el movimiento libre de las sustancias a través de la bicapa lipídica sin la ayuda de proteínas transportadoras de membrana. Las moléculas hidrófobas no polares atraviesan la bicapa lipídica a través de este proceso.
Osmosis
Es un tipo especial de difusión que implica el movimiento neto de agua (el principal solvente en los sistemas biológicos) a través de una membrana semipermeable de una región de mayor concentración a una región de menor concentración.
Es un tipo especial de difusión que implica el movimiento neto de agua (el principal solvente en los sistemas biológicos) a través de una membrana semipermeable de una región de mayor concentración a una región de menor concentración.
La presión osmótica de una disolución se define como aquella presión que debe ejercerse sobre el lado de una membrana semipermeable con la más alta con contracción de soluto, para impedir la difusión del agua (por ósmosis) desde el lado con la concentración más baja de soluto.
Diálisis
La diálisis es definida como un procedimiento terapéutico por medio del cual se eliminan sustancias tóxicas presentes en la sangre. Como ya se ha referido, el tratamiento de diálisis consiste en dos tipos de procedimientos: La hemodiálisis y la diálisis peritoneal. El tratamiento de hemodiálisis (HD) consiste en dializar la sangre a través de una máquina que hace circular la sangre desde una arteria del paciente hacia el filtro de diálisis o dializador en el que las sustancias tóxicas de la sangre se difunden en el líquido de diálisis; la sangre libre de toxinas vuelve luego al organismo a través de una vena canulada. (Rodríguez D. J., 2017)
Adsorción
 |
| Fuente: https://t1.uc.ltmcdn.com/images/4/6/0/img_como_funciona_la_dialisis_22064_600.jpg |
La adsorción puede definirse como la tendencia de un componente del sistema a concentrarse en la interface, donde la composición inter-facial es diferente a las composiciones correspondientes al seno de las fases. Hay una clara diferencia entre el fenómeno de adsorción y el de absorción, en el segundo existe una penetración física de una fase en la otra; sin embargo, es factible que ambos sucedan simultáneamente, y en este caso puede ser muy difícil separar los efectos de ambos fenómenos, inclusive un fenómeno puede afectar al otro.
En los procesos de adsorción hay dos aspectos que deben ser considerados;
· El efecto de la adsorción sobre la energía interfacial del sistema en el equilibrio (termodinámica) .
· La rapidez del proceso de adsorción (cinética).
Fenómenos Físicos y Químicos
Fenómenos físicos
Son los cambios que se presentan en la materia sin alterar su constitución.
Fenómenos Químicos
Son los cambios que presentan las sustancias cuando, al reaccionar unas con otras, pierden sus características originales y dan lugar a otra sustancia, con propiedades diferentes. (CARROSO, 2018)
Magnitudes y medidas
¿A que denominamos magnitud?
Se denomina «magnitud» a cierta propiedad o aspecto observable de un sistema físico que puede ser expresado en forma numérica. En otros términos, las magnitudes son propiedades o atributos que se pueden medir.
¿Qué es la medición?
Al medir en realidad comparamos la magnitud (tamaño) de la cantidad física con un patrón universal aceptado como unidad de medida.
Método o formas de medir
Los procedimientos para medir cantidades pueden clasificarse como se muestra a continuación:
• Cómo contar: El procedimiento de contar consiste en determinar el número de elementos de un conjunto de objetos y proporciona una medida exacta. Un ejemplo sería contar el número de naranjas contenido en una bolsa.
• Medición directa Por lo general es un proceso visual que consiste en comparar de manera directa la magnitud de una cantidad física con una unidad de medida patrón o estándar
• Medición indirecta Muchas cantidades físicas no se pueden medir directamente.
(Carvajal I. J., 2013)
Fuerza y Energía
Concepto de fuerza y energía
Energía y fuerza son conceptos muy relacionados, aunque son distintos entre sí. Básicamente, la energía está presente en todos los cuerpos (si el cuerpo está en reposo posee energía potencial y si está en movimiento la energía potencial se ha transformado en energía cinética). La fuerza es una acción que solo se puede expresar cuando hay interacción entre dos cuerpos. (Pacheco, 2017)
¿Qué es la fuerza?
Tenemos una idea de qué es una fuerza en términos de la acción de empujar, jalar o tirar de algún objeto. La experiencia cotidiana enseña que el movimiento de un objeto es resultado de sus interacciones con otros objetos circundantes. Cuando un jugador golpea una pelota existe una interacción con ésta que modifica su movimiento. En física, las interacciones entre dos objetos se expresan cuantitativamente en términos del concepto llamado fuerza.
Las fuerzas en el universo se pueden explicar en función de cuatro interacciones básicas que ocurren entre los objetos:
- La fuerza gravitacional es la fuerza de atracción mutua entre dos objetos por el simple hecho de tener masa. Es la causa de que los planetas se mantengan en órbita alrededor del Sol y la Luna en torno a la Tierra.
- La fuerza electromagnética es la fuerza entre cargas eléctricas e incluye las fuerzas eléctricas y las fuerzas magnéticas. Las fuerzas eléctricas existen entre carga eléctricas que están en reposo y las fuerzas magnéticas se producen por la interacción de cargas eléctricas en movimiento.
- La fuerza nuclear fuerte resulta de la interacción entre partículas subatómicas y es la responsable de mantener unidas las partículas en los núcleos atómicos. La explosión de la bomba de hidrógeno es un ejemplo de la potencia de esta fuerza.
- La fuerza nuclear débil es la que resulta de la interacción entre las partículas subatómicas durante algunos procesos de decaimiento radiactivo.
(Carvajal I. J., 2013)
¿Qué son las fuerzas intermoleculares?
Las fuerzas intermoleculares son fuerzas de atracción entre las moléculas.
Las fuerzas intermoleculares suelen ser más débiles que las intermoleculares, por ello se necesita menor energía para evaporar un líquido que para romper los enlaces de sus moléculas.
¿Qué es la energía?
La energía es la capacidad de realizar trabajo. Dicho de otra manera, siempre que algo tiene la facultad de realizar trabajo se dice que tiene energía. La energía existente en el universo es constante, es decir, su cantidad total no aumenta ni disminuye.
 |
| Fuente: https://blogdelrunner.com/wp-content/uploads/2014/02/ATP-la-energia-que-mueve-al-runner.jpg |
Elasticidad y resistencia de los tejidos humanos.
Alrededor de 85% de la masa muscular esquelética del ser humano está compuesto por fibras musculares propiamente dichas, el 15% restante está formado en gran parte por tejido conectivo compuesto en cantidades variables por fibras colágenas, reticulares y elásticas.
Fibras colágenas. Son las más abundantes. Están formadas por la proteína colágeno. Brindan rigidez y resistencia al tejido. El colágeno es la proteína más abundante del organismo humano, representando el 30% del total. Se encuentran en la gran mayoría de los tejidos conectivos, sobre todo en el hueso, el cartílago, los tendones y los ligamentos. Son flexibles y resistentes.
Fibras elásticas. Son más pequeñas que las de colágeno, se ramifican y vuelven a reunirse libremente unas con otras. Están constituidas por la proteína (colágeno) y elastina. Al igual que las fibras de colágeno, proporcionan resistencia, pero además pueden estirarse ampliamente, sin romperse. Las fibras elásticas son muy abundantes en la piel, los vasos sanguíneos y los pulmones, se estiran sin romperse hasta el 150% de su longitud.
Resistencia y estructura de los músculos y huesos:
Estructura del hueso: El hueso es un tejido duro que constituye la mayor parte del esqueleto y consta de elementos orgánicos (células y matriz) e inorgánicos (minerales). Sus componentes son: cartílago, disco epifisiario, hueso compacto, endostio, medula ósea, abertura, vasos nutrientes.
Resistencia de los huesos: Los huesos les confiere una enorme resistencia y les permite soportar sin problema todo el peso del resto del cuerpo. La fortaleza de los huesos se debe principalmente a su estructura interna, construida a partir de miles de unidades tubulares compactadas en torno al perímetro del hueso: los sistemas haversianos. (Sanchez I. S., 2017)
| Fuente: http://www.elmuroed.com/Resources/galleries/flexibilidad.jpg |
Materia y Energía
Materia
Es todo aquello que ocupa un lugar en el espacio y posee masa, de tal manera que todo lo que nos rodea está constituido por materia, como por ejemplo el aire que respiramos, los alimentos que ingerimos, el agua que bebemos, los materiales que usamos y en general, todo lo que conforma el universo. (Gonzalez O. , 2013)
Ley de la conservación de la materia
Todo cambio químico establece una relación cualitativa entre las sustancias iniciales y los productos que se obtienen y determina las cantidades de las sustancias que intervienen durante una reacción. Este principio fue establecido en la última mitad del siglo XVIII por el químico francés Antoine Laurent Lavoisier (1743-1794), lo que constituyó un gran aporte al desarrollo y consolidación de la química como ciencia. La aplicación de la balanza y de la medición de masas permitió descubrir que en cualquier proceso químico la suma de las masas de las sustancias que intervienen reactante es idéntica a la de las sustancias que se forman como consecuencia de la reacción. (Gonzalez O. , 2013)
Definición de energía
Se define como la capacidad de la materia para ejecutar un trabajo. Los cambios de energía que acompañan a las transformaciones químicas y físicas de la materia se ponen de manifiesto en diferentes formas de acuerdo al tipo de movimiento y se pueden convertir en otras formas de energía. (Gonzalez O. , 2013)
Ley de la conservación de la energía
La energía puede convertirse de una forma a otra, pero la cantidad total de energía permanece constante. “La energía no se crea ni se destruye, sólo se transforma” La energía es inherente a los cuerpos y está presente en diversas formas debido a su movimiento, a su posición, a la relación entre las partículas que la forman, a la temperatura, entre otras. En las diversas áreas de la ciencia y la tecnología se dan diversas definiciones de energía, todas ellas relacionadas entre sí y con el concepto de trabajo. La energía que involucra movimiento se la denomina energía cinética y la que se refiere al reposo se llama energía potencial. El calor, las radiaciones y la electricidad son otras formas específicas de energía.
Existen además otros tipos de energía que se relacionan con los procesos que se realizan, así conocemos:
· Energía hidráulica: Es la que s e obtiene del aprovechamiento de la energía
cinética y potencial de la corriente de agua.
· Energía nuclear: Es aquella que es liberada como resultado de una reacción
que se produce en los núcleos de los átomos, ya sea por combinación de núcleos livianos (fusión nuclear).
· Energía geotérmica: Es aquella que se obtiene por el aprovechamiento del calor del interior de la tierra.
· Energía eólica: Se obtiene del viento y por utilización de la energía cinética generada por las corrientes de aire.
· Energía solar: Es la energía que s e obtiene directamente del sol, cuya capacidad puede aprovecharse e n forma directa o por acumulación e n un dispositivo. E s un tipo de energía limpia y renovable.
 |
| Fuente: https://www.fuentesdeenergiarenovables.com/wp-content/uploads/2017/08/tipos-de-energia-1-1024x568.jpg |
Las leyes de la termodinámica
La termodinámica
La termodinámica ofrece una descripción macroscópica de las propiedades de un sistema en términos de la presión, el volumen, la temperatura y la densidad, entre otras, delimitados por los alrededores inmediatos y que se encuentran relacionados con ciertas características con respecto a la masa y la energía. Las leyes de la termodinámica nos permiten estudiar todo tipo de procesos fisicoquímicos a partir del principio de conservación de la energía y el principio del aumento de entropía. Las correlaciones entre diferentes parámetros termodinámicos nos permiten analizar los cambios en los sistemas en términos de la primera y segunda leyes de la termodinámica y expresarlos en términos de las constantes de equilibrio de los diferentes procesos.
Primera ley de la termodinámica
La primera ley de la termodinámica establece que la energía no se puede crear ni destruir, es decir, que corresponde con la ley de la conservación de la energía. En esta sección analizaremos las condiciones de cambio de energía del sistema y su medio circundante durante procesos termodinámicos como la compresión y expansión de un gas. En un sistema aislado la energía interna U permanece constante. Sin embargo, si dicho sistema no está aislado se manifiesta una trasferencia de energía con sus alrededores, que da como resultado que uno de ellos (el sistema o sus alrededores) gane energía mientras el otro la pierda.
Segunda ley de la termodinámica
La primera ley de la termodinámica establece que la energía se conserva. Sin embargo, podemos pensar en varios procesos termodinámicos en donde la energía se conserva pero que es imposible que ocurran. Por ejemplo:
· Cuando un cuerpo frío y uno caliente se ponen en contacto no puede ocurrir que el caliente aumente su temperatura y el frío disminuya su temperatura. No se viola la primera ley, pero es imposible que ocurra.
· Se ha encontrado que una cantidad de trabajo puede convertirse totalmente el calor, pero nunca se ha podido encontrar un procedimiento que convierta por completo una cantidad de calor en trabajo. La primera ley no restringe la capacidad de convertir trabajo en calor o calor en trabajo, solo especifica que la energía debe conservarse durante el proceso.
(Chumacero L. A., 2014)
¿Que determina la segunda ley de la termodinámica?
¿Que determina la segunda ley de la termodinámica?
Determina cuáles de los procesos que cumplen con la primera ley ocurren espontáneamente, o bien, requieren de energía adicional para llevarse a cabo.
Tercera ley de la termodinámica
La segunda ley está ligada a una variable termodinámica denominada entropía (S), y puede expresarse cuantitativamente en términos de esta variable. En el análisis de muchas reacciones químicas es necesario fijar un estado de referencia para la entropía En consecuencia, comúnmente se establece la tercera ley en forma más general, como: “La entropía de cualquier sustancia pura en equilibrio termodinámico tiende a cero a medida que la temperatura tiende a cero”. La importancia de la tercera ley es evidente. Suministra una base para el cálculo de las entropías absolutas de las sustancias, las cuales pueden utilizarse en las ecuaciones apropiadas para determinar la dirección de las reacciones químicas.
Las leyes de la termodinámica en los seres vivos
Los seres vivos presentan un constante flujo de energía porque son sistemas termodinámicos abiertos, ya que continuamente están intercambiando materia, energía e información con su medio ambiente, con el que mantienen un equilibrio dinámico. Todos los seres vivos realizan tres funciones básicas: relación, nutrición y reproducción y como resultado del proceso evolutivo, todos los organismos, independientemente de la complejidad que poseen, presentan determinadas características comunes que implican transformaciones continuas e intercambio de energía, relacionadas con el funcionamiento del individuo como sistema termodinámico. (Rodríguez M. A., 2014)
 |
| Fuente: https://slideplayer.es/slide/19765/1/images/11/SERES+VIVOS+Sistemas+termodin%C3%A1micos+abiertos+en+estado+estacionario.jpg |




No hay comentarios.:
Publicar un comentario